マイコプラズマ感染症の概要
 マイコプラズマ感染症は、風邪症候群に似た症状を示し、初期の症状は発熱や倦怠感、頭痛など、風邪に似ているが、長引く咳が特徴とされる(乾性咳嗽の発症率は75~100%)[1]。
マイコプラズマ感染症は、風邪症候群に似た症状を示し、初期の症状は発熱や倦怠感、頭痛など、風邪に似ているが、長引く咳が特徴とされる(乾性咳嗽の発症率は75~100%)[1]。
痰が少ない乾性咳嗽が、解熱後3~4週間続くこともある。ときに肺炎を起こし、まれに重症化することがある[2,3,4]。
感染経路と疫学:
主に患者の咳のしぶきを吸い込むことにより感染する(濃厚接触時の飛沫感染)。家庭内や学校などのコミュニティで感染する。
感染してから発病するまでの潜伏期間は2~3週間と長く、咳の症状が続いてもあまり熱が出ないため、自分で気がつかない間に他人にうつすことが多い[5]。
家族の一人が感染すると家族内の伝染は90%に達する。感染は秋から冬に多いが、通年で感染する可能性がある[6]。
感染後は終生免疫が得られないので、再度感染する可能性がある[7]。ヨーロッパで実施された約10年間(2003 ~ 2012)の観察研究では、10年間に3回の大流行を観察した。
それらは、3~4年周期で秋の流行を認めた[8]。他の地域でも同じような間隔(4年程度)で流行を認めたため(最近はそうでもないが)、以前はオリンピック病と呼ばれた。
肺炎と重症化:
入院適応のある全て市中肺炎のうち、約5%がマイコプラズマ肺炎とされる。ただし、流行期は約10%に上昇する[9]。
ちなみに、非定型肺炎全体(マイコプラズマ、クラミジア、レジオネラなど)としては、入院が必要な市中肺炎の約20%を占めるとされている[10,11]。
軍隊組織(健康成人の集まり)で流行した際に、肺炎に至った患者の率や特徴を調べた研究がある。これによると全罹患者のうち11%が肺炎に至った。
また、①もともと免疫グロブリン量が少ない者、あるいは②喫煙しているもの、が有意に肺炎の発症に関与していた[12]。
複数の報告をまとめたレビューでは、マイコプラズマ感染症が肺炎に至る確率は3~11%で、高齢者、基礎疾患を有する者、喫煙者、などが肺炎のリスクが高いとされた[13]。
マイコプラズマによる肺炎の多くは軽症であるが、重症型(呼吸不全)に至ることがある[14,15,16,17]。 死亡例は、びまん性の肺炎や、ARDS、DICを合併する[14]。
マイコプラズマの呼吸器症状
マイコプラズマ感染症の症状は、呼吸器症状と呼吸器以外の症状(肺外症状)に分けることができる[18]。
呼吸器症状としては、肺炎(3~10%)、咽頭炎(6~59%)、鼻炎(2~40%)、耳痛(2~35%)、その他副鼻腔炎症状などがある[19]。
これら呼吸器症状は、菌による直接障害ではなく、宿主の免疫応答を介した免疫発症である(インフルエンザなどのウイルス性疾患とは発症機序が違う)。
マイコプラズマ肺炎ははじめ聴診所見に乏しいが、病状の進行とともに徐々に湿性ラ音やウィーズを認めるようになる[20]。
肺炎患者の15~20%は胸水を認める。胸水は漿液性であり、胸膜痛や膿胸はまれである。ひどい咳による胸痛をしばしば認める。
マイコプラズマの呼吸器外症状
呼吸器外症状(肺外病変)には、溶血[21]、皮膚紅潮、関節障害、胃腸障害、中枢神経障害、心機能障害などがある。
はっきり解明されていないが、おそらく肺外病変も宿主の免疫応答を介した免疫発症と推測されている。
これらの肺外病変は限られた5~10%の患者にしか出現しないが、細菌性肺炎との鑑別に寄与することもある。
皮膚症状:
皮膚症状は、紅斑丘疹や水疱性発疹からSJSまで幅広い。
あるレポートによると、SJS患者の16%がマイコプラズマ感染を伴っていた。
マイコプラズマはSJSと関連する最もポピュラーな感染症である[22]。 SJSを合併しているマイコプラズマ感染症は、上気道感染ではなく肺炎であることが多い[23]。
レイノー現象も、マイコプラズマ感染症で認められることがある。これはおそらく寒冷凝集素の形成に関連して起こる現象である。[14]。
中枢神経系合併症:
中枢神経障害は、全マイコプラズマ感染の0。1%に、そして入院の必要なマイコプラズマ感染症の約7%に認められる[24]。
小児に多く、多くは脳炎で発症する [25]。その他、無菌性髄膜炎、末梢神経障害、横断性脊髄炎、脳神経麻痺、小脳失調などを認める[26,27]。
急性横断性脊髄炎(ATM)や急性散在性脳脊髄炎(ADEM)はマイコプラズマ感染の合併症として最も重症なものである。
あるレビューによると脊髄病変を負った患者の59%は、何らかの永久的な後遺症を負った[28]。
中枢神経障害は生命に関わる。あるスタディでは、61名の中枢神経合併症患者のうち5名(8%)が死亡し、14名(23%)が重度の後遺症を負った[24]。
心機能障害:
マイコプラズマ感染症に合併する心機能障害にはリズム障害、心不全、胸痛、心電図上の伝導障害などがある[29]。
あるコホート研究によれば、マイコプラズマ感染患者の方が、そうでない患者に比較して急性冠症候群を発症するリスクが1.3倍多いとされた[30]。
他の合併症:
リウマチ性合併症もある。例えば、多発関節痛、筋痛、などである[31]。
糸球体腎炎も稀だがある。おそらく免疫複合体の沈着による。ある症例報告では、寒冷凝集素の上昇と関連づけて糸球体腎炎が報告されているが、その因果関係は証明されていない[32]。
胃腸障害は稀だが肝炎は8%に認め[33,34]、まれに免疫複合体による膵炎[35]や、ブドウ膜炎[36,37]、中耳炎と水疱性鼓膜炎(鼓膜に水疱を認める中耳炎)[38]などの報告がある。
細菌性肺炎との鑑別
マイコプラズマは、臨床症状が多彩であり、また軽症のことも多いため、診断に至らないことが多い[39]。
呼吸器症状はライノウイルスやインフルエンザ感染症に似ている。また他の細菌感染の合併により咽頭炎や咳などの症状が出ていることもある[40]。
細菌性肺炎との鑑別は、現在のところ成人市中肺炎ガイドラインに基づき、年齢、基礎疾患の有無、臨床症状、および末梢白血球数などの情報により行われている(表1)。
この鑑別方法は良好な感度と特異度が証明されている[41]。
また、マイコプラズマや他の非定型肺炎では、細菌性肺炎と比較して、肺外合併症を呈することが多い。
よって状況によっては、病歴と肺外病変の存在により細菌性肺炎と区別することができる。
しかしマイコプラズマの多彩な臨床症状や、症例による重症度の大幅な違いなどにより、鑑別が難しい場合が多い[42]。
そういった意味でも、下記の諸検査は重要である。
表1(細菌性肺炎との鑑別)

マイコプラズマ感染症の検査
検査方法:
検査方法には、①培養検査、②抗体検査法、③抗原検査法、④遺伝子検出法、の4つがある。
 マイコプラズマは短桿菌だが細胞壁がないため、グラム染色では見えない[14]。
マイコプラズマは短桿菌だが細胞壁がないため、グラム染色では見えない[14]。
特殊な培地でマイコプラズマを発育させることは可能だが2~3週かかるうえにうまく生えないことが多い。
結果として、ほとんどの病院の検査室ではマイコプラズマの培養は実施していない。従って、日常臨床においては培養検査以外の方法で診断を付けるしかない。
抗体検査:
抗体検査としては寒冷凝集反応(cold agglutinin reaction; CA)、補体結合反応法(complement fixation;CF)、微粒子凝集法(particle agglutination method;PA)がある。
CAは特異性が低く、マイコプラズマ感染症例の約50%でしか陽性にならない。患者血清とO型赤血球を低温(4℃)で数分間培養し,赤血球凝集が起こるかどうかで診断する。
肉眼的に凝集が認められたら患者血清を希釈していき、凝集が起きる最も希釈された力価が寒冷凝集素価となり、32倍以上でマイコプラズマ感染症が疑われる。
ただしEB,サイトメガロなどのウイルス感染症やリンパ腫でも寒冷凝集素価は上昇する[43,44]。
CFはCAよりもはるかに特異性が高いが、発症後2~3週頃に上昇するため、早期診断、治療に結果を反映しがたい。
主にマイコプラズマに対する抗IgG抗体を検出する[45]。PAは主にマイコプラズマに対する抗IgM抗体を検出する。
抗体検査による診断は発症早期の陽性率は低いため、2~3 週間後の回復期血清が必要となる(ペア血清)。
現在の診断基準では、ペア血清による診断だけでなく、シングル血清でPA320倍以上、CF64倍以上でも確定診断としているが、単一血清による診断では偽陽性の可能性を常に念頭に置く必要がある[46]。
抗原検査法(図1):
抗体検査法は検査結果が出るまでに通常2週間程度かかるため早期診断が難しく、また小児に2回採血することはそれ自体ハードルとなる。
これに対し、咽頭ぬぐい液などからマイコプラズマの菌体成分を高感度、高特異度で検出する抗原検査法があれば理想的である。
マイコプラズマの抗原検査はこれまでいくつか方法が報告されているが、感度と特異度が(あるいはいづれかが)十分ではなく、決定的な方法は普及していない[47]。
当院で採用しているマイコプラズマ抗原キット:リボテスト®は特異度が高く有用である。これは咽頭ぬぐい液を用いたイムノクロマトグラフィ法による簡便な検査であり特異度が高い(感度57.1%、特異度92.2%)[48]。
これを用いると、検査後30分以内に、「リボテスト陽性なので疾患陽性(92%以上)」と判断し早期治療を開始できる。
このように患者への負担が少なく、早期治療につながる抗原検査の、さらなる(とくに成人の)エビデンスの集積が待たれる。
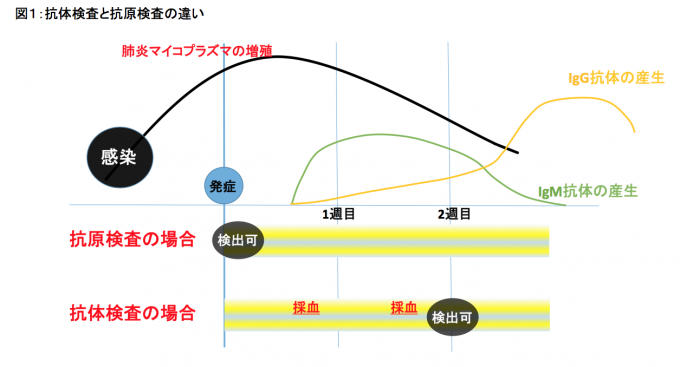
https://www.asahi-kasei.co.jp/shindan/ribotest/feat.html より引用(一部修正)
遺伝子検出法:
PCR法やLAMP法(Loop−Mediated Isothermal Amplification法)などの遺伝子検出法は、感度・特異度ともに高い[49-52]。
とくにLAMP法は、特殊なPCR器機を必要とせず、迅速性と簡便性に優れている。
実際の臨床における評価でも、LAMP法と培養法との一致率は咽頭拭い液で95.6%、喀痰では98.5%であり、PCR法との一致率も97.8%と非常に高い[53]。
マクロライド耐性
マクロライド耐性の判断:
マクロライド耐性が諸地域で増加している。とくにアジアで。
2008年から2013年にかけて実施された日本のサーベランスでは、小児から得られた50~93%の病原体がマクロライド耐性であった。また研究期間を通して増加傾向であった[54]。
中国から報告では、成人呼吸器感染患者の病原体マイコプラズマの95%がマクロライド耐性であった[55]。フランスやアメリカでも5~13%と報告されている[56-58]。
耐性マイコプラズマの診断は塩基配列の解析(シーケンス)か分離培養によるMIC測定のいずれかを行う必要があり、実際の臨床レベルで行われている血清学的診断(PA法,CF法、迅速診断法など)やDNA診断(PCR法およびLAMP法)では耐性の有無を判断することはできない。
しかし、上記の耐性検査には特殊な機器と多大の費用を要することや,マイコプラズマの培養にはPPLO培地という特殊な培地を必要とし、菌の発育に1週間~1 カ月を要することから、国内では実施できる施設が限られている。そのため、一般には実際に目の前にした症例がマクロライド耐性であるかどうかを検査によって確認しながら治療を行う方法はない。
かわりに現状では、外来レベルでは、抗菌薬投与後の有熱期間をもって耐性の有無を推測している[59]。
具体的には、マクロライド投与後の感受性マイコプラズマ感染例の平均有熱期間は1.4日で、耐性マイコプラズマ感染例のほうが平均約2日の発熱遷延がみられるなど、マクロライド投与時に耐性株の場合には48時~72時間以上の発熱が続く[60]。
つまりマクロライド投与後も2~3日発熱が続く場合には、マクロライド耐性マイコプラズマ感染症の可能性が高いと推察できる。ただし、マクロライド耐性マイコプラズマ感染症であっても,2~3日以内に自然に解熱に達する場合もある。
また、小児における疫学データでは、マクロライド系薬の前投与があり、症状の改善がなければ耐性率は90%以上であるが、マクロライド系薬の前投薬与がないときの耐性率は50%以下であった[61]。
マイコプラズマ肺炎の治療
抗菌薬の選択:
JEID/JSC感染症治療ガイドライン2014(http://www.kansensho.or.jp/guidelines/pdf/guideline_jaid_jsc.pdf)や、肺炎マイコプラズマ肺炎に対する治療指針(http://square.umin.ac.jp/jsm/shisin.pdf)などを総合すると、
| 第一選択 | AZM(アジスロマイシン) 点滴静注1回500mg/1日1回 5日間 MINO(ミノマイシン) 点滴静注1回100mg/1日2回 7~10日間 |
|---|---|
| 第二選択 | LVFX(クラビット)点滴静注1回500mg/1日1回 7~10日間 CPFX(シプロフロキサシン)点滴静注1回300mg/1日2回 7~10日間 |
となっている。
第二選択のレスピラトリーキノロンは耐性化防止の観点からできるだけ控える。
第一選択のMINOとAZMの両剤に明確な優先順位はない。感受性があればAZMの有効性が勝るが、マクロライド耐性であればMINOが推奨される。
その点から、重症例には確実な効果を得るためにこれら2剤の併用療法も検討するべきと考える。さらに、重症度が高くcriticalな場合は、レスピラトリーキノロンの使用を考慮する。
投与終了のタイミング:
マイコプラズマには細胞内に入り込む能力があるので、長期間の抗菌薬投与が必要である。
しかし期間について検討した研究は少ない。肺炎マイコプラズマ肺炎に対する治療指針(日本マイコプラズマ学会)では、AZM以外は7~10日間がexpert opinionとして推奨されている。AZMはup to dateでexpert opinionとして5日間投与が紹介されている。
しかし、抗菌薬の中止には慎重になるべきで、固定的な投与期間設定にこだわるのではなく、病態改善を示すサインや症状を見極めながら臨機応変に投与期間を設定するべきと思われる。
重症化の原因と治療:
成人におけるマイコプラズマ肺炎の予後は一般に良好であるものの、呼吸不全を呈する症例も少なからず存在する。
重症マイコプラズマ肺炎の病態は、マイコプラズマに対する過剰な免疫応答がその主体と考えられており、抗炎症作用を狙ったステロイド薬の全身投与も検討されている[60,62]。
重症化する危険因子について前向きの疫学研究はないが、Miyashitaらの報告では、227例のマイコプラズマ肺炎症例(13例が人工呼吸器を要した)で、急性呼吸不全を呈した症例は、適切な抗マイコプラズマ薬の投与が遅れていたと報告した23)。
また、Izumikawaらのretrospec
tiveなレビューでも、検討された52例のうち、41例で抗マイコプラズマ薬以外の抗菌薬が使用されており、適切な初期治療が呼吸不全発症の予防として重要であると報告されている24)。一方、マクロライドに対する耐性化と呼吸不全発症の関係について検討された研究はいまのところ存在せず、今後の研究成果が待たれる。
ステロイドの投与量、投与期間についてもエビデンスに乏しいが、Miyashitaらの報告では、人工呼吸を要した13例中の9例で高用量のステロイドが使用された23)とあり、Izumikawaらの検討でも、呼吸不全を伴った成人マイコプラズマ肺炎症例のうち、ステロイド薬が使用された18例のうち7例は、メチルプレドニゾロンを500mg/日以上で開始され、全例、5日以内に呼吸不全が改善したと報告されている24)。
肺炎マイコプラズマ肺炎に対する治療指針Expert opinionとして、呼吸不全を呈するマイコプラズマ肺炎に対しては、適切な抗マイコプラズマ薬とメチルプレドニゾロン500−1000mg/日3−5日間の併用投与を行うことが推奨されている。(文責:新井隆男)
◇◆◇
(参考文献)
1. Mansel JK, Rosenow EC 3rd, Smith TF, Martin JW Jr. Mycoplasma pneumoniae pneumonia. Chest 1989; 95:639.
2. Luby JP. Pneumonia caused by Mycoplasma pneumoniae infection. Clin Chest Med 1991; 12:237.
3. Clyde WA Jr. Clinical overview of typical Mycoplasma pneumoniae infections. Clin Infect Dis 1993; 17 Suppl 1:S32.
4. Lieberman D, Schlaeffer F, Lieberman D, et al. Mycoplasma pneumoniae community-acquired pneumonia: a review of 101 hospitalized adult patients. Respiration 1996; 63:261.
5. Clyde WA Jr. Clinical overview of typical Mycoplasma pneumoniae infections. Clin Infect Dis 1993; 17 Suppl 1:S32.
6. Luby JP. Pneumonia caused by Mycoplasma pneumoniae infection. Clin Chest Med 1991; 12:237.
7. Foy HM, Kenny GE, Cooney MK, Allan ID. Long-term epidemiology of infections with Mycoplasma pneumoniae. J Infect Dis 1979; 139:681.
8. Kim EK, Youn YS, Rhim JW, et al. Epidemiological comparison of three Mycoplasma pneumoniae pneumonia epidemics in a single hospital over 10 years. Korean J Pediatr 2015; 58:172.
9. Marrie TJ. Mycoplasma pneumoniae pneumonia requiring hospitalization, with emphasis on infection in the elderly. Arch Intern Med 1993; 153:488.
10. Bartlett JG, Mundy LM. Community-acquired pneumonia. N Engl J Med 1995; 333:1618.
11. Hammerschlag MR. Mycoplasma pneumoniae infections. Curr Opin Infect Dis 2001; 14:181.
12. Klement E, Talkington DF, Wasserzug O, et al. Identification of risk factors for infection in an outbreak of Mycoplasma pneumoniae respiratory tract disease. Clin Infect Dis 2006; 43:1239.
13. Mansel JK, Rosenow EC 3rd, Smith TF, Martin JW Jr. Mycoplasma pneumoniae pneumonia. Chest 1989; 95:639.
14. Baum SG. Mycoplasma pneumoniae and atypical pneumonia. In: Principles and Practice of Infectious Diseases, 7th Ed, Mandell GL, Bennett JE, Dolin R (Eds), Churchill Livingstone, Philadelphia 2010. p.2481.
15. Case records of the Massachusetts General Hospital. Weekly clinicopathological exercises. Case 5-1992. A 20-year-old man with diffuse pulmonary infiltrates and disseminated intravascular coagulation. N Engl J Med 1992; 326:324.
16. Chan ED, Welsh CH. Fulminant Mycoplasma pneumoniae pneumonia. West J Med 1995; 162:133.
17. Kannan TR, Hardy RD, Coalson JJ, et al. Fatal outcomes in family transmission of Mycoplasma pneumoniae. Clin Infect Dis 2012; 54:225.
18. Clyde WA Jr. Clinical overview of typical Mycoplasma pneumoniae infections. Clin Infect Dis 1993; 17 Suppl 1:S32.
19. Martin RE, Bates JH. Atypical pneumonia. Infect Dis Clin North Am 1991; 5:585.
20. Clyde WA Jr. Clinical overview of typical Mycoplasma pneumoniae infections. Clin Infect Dis 1993; 17 Suppl 1:S32.
21. Gro?hennig S, Ischebeck T, Gibhardt J, et al. Hydrogen sulfide is a novel potential virulence factor of Mycoplasma pneumoniae: characterization of the unusual cysteine desulfurase/desulfhydrase HapE. Mol Microbiol 2016; 100:42.
22. Tay YK, Huff JC, Weston WL. Mycoplasma pneumoniae infection is associated with Stevens-Johnson syndrome, not erythema multiforme (von Hebra). J Am Acad Dermatol 1996; 35:757.
23. Olson D, Watkins LK, Demirjian A, et al. Outbreak of Mycoplasma pneumoniae-Associated Stevens-Johnson Syndrome. Pediatrics 2015; 136:e386.
24. Koskiniemi M. CNS manifestations associated with Mycoplasma pneumoniae infections: summary of cases at the University of Helsinki and review. Clin Infect Dis 1993; 17 Suppl 1:S52.
25. Daxboeck F. Mycoplasma pneumoniae central nervous system infections. Curr Opin Neurol 2006; 19:374.
26. Bitnun A, Ford-Jones E, Blaser S, Richardson S. Mycoplasma pneumoniae ecephalitis. Semin Pediatr Infect Dis 2003; 14:96.
27. Smith R, Eviatar L. Neurologic manifestations of Mycoplasma pneumoniae infections: diverse spectrum of diseases. A report of six cases and review of the literature. Clin Pediatr (Phila) 2000; 39:195.
28. Tsiodras S, Kelesidis T, Kelesidis I, et al. Mycoplasma pneumoniae-associated myelitis: a comprehensive review. Eur J Neurol 2006; 13:112.
29. Martin RE, Bates JH. Atypical pneumonia. Infect Dis Clin North Am 1991; 5:585.
30. Chung WS, Hsu WH, Lin CL, Kao CH. Mycoplasma pneumonia increases the risk of acute coronary syndrome: a nationwide population-based cohort study. QJM 2015; 108:697.
31. Chaudhry R, Nisar N, Malhotra P, et al. Polymerase chain reaction confirmed Mycoplasma pneumoniae arthritis: a case report. Indian J Pathol Microbiol 2003; 46:433.
32. Vitullo BB, O’Regan S, de Chadarevian JP, Kaplan BS. Mycoplasma pneumonia associated with acute glomerulonephritis. Nephron 1978; 21:284.
33. Luby JP. Pneumonia caused by Mycoplasma pneumoniae infection. Clin Chest Med 1991; 12:237.
34. Romero-G?mez M, Otero MA, S?nchez-Mu?oz D, et al. Acute hepatitis due to Mycoplasma pneumoniae infection without lung involvement in adult patients. J Hepatol 2006; 44:827.
35. Kim KW, Sung JJ, Tchah H, et al. Hepatitis associated with Mycoplasma pneumoniae infection in Korean children: a prospective study. Korean J Pediatr 2015; 58:211.
36. Weinstein O, Shneck M, Levy J, Lifshitz T. Bilateral acute anterior uveitis as a presenting symptom of Mycoplasma pneumoniae infection. Can J Ophthalmol 2006; 41:594.
37. Yashar SS, Yashar B, Epstein E, Viani RM. Uveitis associated with Mycoplasma pneumoniae meningitis. Acta Ophthalmol Scand 2001; 79:100.
38. RIFKIND D, CHANOCK R, KRAVETZ H, et al. Ear involvement (myringitis) and primary atypical pneumonia following inoculation of volunteers with Eaton agent. Am Rev Respir Dis 1962; 85:479.
39. Braun GS, Wagner KS, Huttner BD, Schmid H. Mycoplasma pneumoniae: usual suspect and unsecured diagnosis in the acute setting. J Emerg Med 2006; 30:371.
40. Gouriet F, Drancourt M, Raoult D. Multiplexed serology in atypical bacterial pneumonia. Ann N Y Acad Sci 2006; 1078:530.
41. 日本呼吸器学会呼吸器感染症に関するガイドライン作成委員会. 2007. 成人市中肺炎診療ガイドライン. 日本呼吸器学会, 東京.
42. Cunha BA. The atypical pneumonias: clinical diagnosis and importance. Clin Microbiol Infect 2006; 12 Suppl 3:12.
43. Cunha BA. The atypical pneumonias: clinical diagnosis and importance. Clin Microbiol Infect 2006; 12 Suppl 3:12.
44. Jacobs E. Serological diagnosis of Mycoplasma pneumoniae infections: a critical review of current procedures. Clin Infect Dis 1993; 17 Suppl 1:S79.
45:Jacobs E. Serological diagnosis of Mycoplasma pneumoniae infections : a critical review of current procedures. Clin Infect Dis 1993 ; 17 Suppl 1 : S79―82.
46. Nir-Paz R, Michael-Gayego A, Ron M, Block C. Evaluation of eight commercial tests for Mycoplasma pneumoniae antibodies in the absence of acute infection. Clin Microbiol Infect 2006; 12:685.
47. Canada Agency for Drugs and Technologies in Health. Serum IgM and molecular tests for Mycoplasma pneumoniae detection: A review of diagnostic test accuracy, clinical effectiveness, cost-effectiveness, and guidelines. CADTH Rapid Response Reports, Ottawa, ON 2015. http://www.ncbi.nlm.nih.gov/pubmedhealth/PMH0084124/pdf/PubMedHealth_PMH0084124.pdf (Accessed on January 13, 2016).
48:Sano G, Itagaki T; Characterization and evaluation of a novel immunochromatographic assay for pharyngeal Mycoplasmapneumoniae ribosomal protein L7/L12 antigens. J Med Microbiol. 2016 Oct;65(10):1105-1110.
49. Tjhie JH, van Kuppeveld FJ, Roosendaal R, et al. Direct PCR enables detection of Mycoplasma pneumoniae in patients with respiratory tract infections. J Clin Microbiol 1994; 32:11.
50. Blackmore TK, Reznikov M, Gordon DL. Clinical utility of the polymerase chain reaction to diagnose Mycoplasma pneumoniae infection. Pathology 1995; 27:177.
51. Waring AL, Halse TA, Csiza CK, et al. Development of a genomics-based PCR assay for detection of Mycoplasma pneumoniae in a large outbreak in New York State. J Clin Microbiol 2001; 39:1385.
52. Dorigo-Zetsma JW, Verkooyen RP, van Helden HP, et al. Molecular detection of Mycoplasma pneumoniae in adults with community-acquired pneumonia requiring hospitalization. J Clin Microbiol 2001; 39:1184.
53. 山口惠三、他:LAMP 法を用いたMycoplasma pneumoniae とLegionella spp。 による呼吸器感染症の迅速診断試薬の評価: 医学と薬学 58:565-571, 2007。
54. Kawai Y, Miyashita N, Kubo M, et al. Nationwide surveillance of macrolide-resistant Mycoplasma pneumoniae infection in pediatric patients.Antimicrob Agents Chemother 2013; 57:4046.
55. Zhao F, Lv M, Tao X, et al. Antibiotic sensitivity of 40 Mycoplasma pneumoniae isolates and molecular analysis of macrolide-resistant isolates from Beijing, China. Antimicrob Agents Chemother 2012; 56:1108.
56. Wolff BJ, Thacker WL, Schwartz SB, Winchell JM. Detection of macrolide resistance in Mycoplasma pneumoniae by real-time PCR and high-resolution melt analysis. Antimicrob Agents Chemother 2008; 52:3542.
57. Diaz MH, Benitez AJ, Winchell JM. Investigations of Mycoplasma pneumoniae infections in the United States: trends in molecular typing and macrolide resistance from 2006 to 2013. J Clin Microbiol 2015; 53:124.
58. Zheng X, Lee S, Selvarangan R, et al. Macrolide-Resistant Mycoplasma pneumoniae, United States. Emerg Infect Dis 2015; 21:1470.
59. Matsubara K, Morozumi M, Okada T, Matsushima T, Komiyama O, Shoji M, et al: A comparative clinical study of macrolide-sensitive and macrolide-resistant Mycoplasma pneumoniae infections in pediatric patients。 J Infect Chemother 2009; 15: 380-3
60. Suzuki S, Yamazaki T, Narita M, Okazaki N, Suzuki I, Andoh T, et al: Clinical evaluation of macrolideresistant Mycoplasma pneumoniae。 Antimicrob Agents Chemother 2006; 50: 709-12
61. 黒崎知道、尾内一信: 1 次医療機関における肺炎マイコプラズのマクロライド耐性 IASR 33 :267-368, 2012。
62. Izumikawa K, Izumikawa KI, Takazono T, Kosai K, Morinaga Y, Nakamura S,Kurihara S, Imamura Y, Miyazaki T,Tsukamoto M, Yanagihara K, Hara K,Kohno S。 Clinical features, risk factors and treatment of fulminant Mycoplasma pneumoniae pneumonia: a review of the Japanese literature。 J Infect Chemother 20:181 − 185, 2014。

 救急科専門研修
救急科専門研修 見学・お問い合わせ
見学・お問い合わせ